پیوند یونی چیست؟
***
پیوند یونی(یا الکترووالانسی) نوعی پیوند شیمیایی است که میان یون های مثبت و منفی با یک نیروی جاذبه قوی (الکتروستاتیک electrostatic) برقرار میشود. این پیوند میان آنیون ها و کاتیون ها ایجاد می شود. هیچ پیوند یونی خالصی وجود ندارد بلکه در هر پیوند یونی که شکل می گیرد درجه ای از پیوند کووالانسی هم هست، در واقع هیچ پیوند یونی ای کاملا یونی نیست. پس پیوند زمانی یونی در نظر گرفته میشود که در آن خاصیت یونی بودن پیوند بیشتر از خاصیت کووالانسی آن باشد، به طوری که هر چه اختلاف الکترونگاتیوی بین اتم ها در پیوند یونی بیشتر باشد پیوند یونی تر است (در بخش الکترونگاتیوی توضیح بیشتری داده شده است). به طور کلی این پیوند میان فلز و نافلز یا فلز و بنیان تشکیل می شود.پیوند یونی اینگونه صورت می گیرد که اتم فلزی الکترون از دست داده به کاتیون تبدیل میشود و اتم نافلز الکترون گرفته به آنیون تبدیل می شود. بعد آنیون ها و کاتیون ها با یک آرایش منظم کنار هم قرار می گیرند به طوری که اطراف هر یون را تعدادی یون با بار مخالف احاطه می کند. جاذبه ی قوی الکتروستاتیک electrostatic که در بالا ذکر شد میان این یون ها ایجاد می شود که به آن پیوند یونی گویند. تصویری از تشکیل پیوند یونی بین سدیم و فلور:
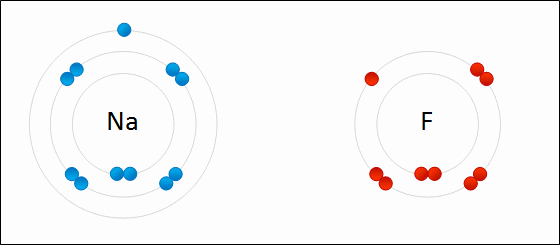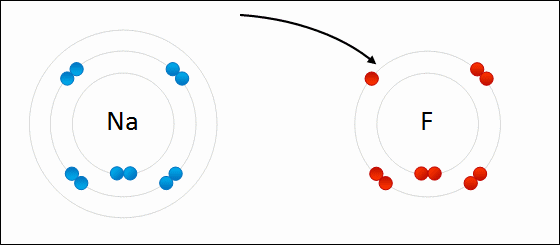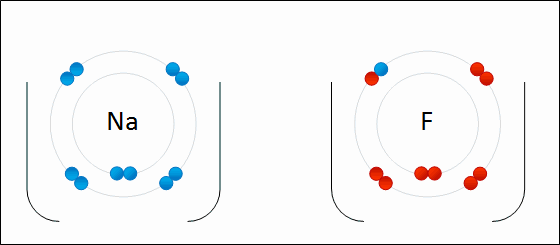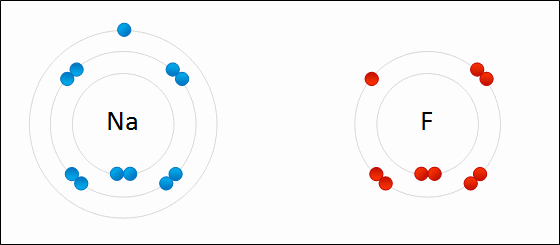
***
به ذرات باردار یون گویند. در واقع اتم عناصر گوناگون(جز عناصر گروه 8 اصلی یا 18که کاملا از نظر آرایش الکترونی پایدارند) بسته به فلز یا نافلز بودن و تعداد الکترون های لایه یوالانس میتوانند الکترون از دست داده یا بدست بیاورند وبه آرایش گاز بی اثر رسیده و پایدار شوند. یون ها بر دو نوعند....
1.1-کاتیون: به یون های با بار مثبت گویند مثل کاتیون سدیم
1.2- آنیون: به یون های با بار منفی گویند مثل یون کلرید
اتم های عناصر فلزی در لایه ی آخر خود 1 یا 2 یا 3 الکترون دارند(جز هیدروژن و هلیم) یعنی با از دست دادن الکترون های لایه ی والانس پایدار می شوند و طی این فرایند دارای بار مثبت می شوند. اما نافلزات که در لایه ی ظرفیتشان 4 یا 5 یا 6 یا 7 الکترون دارند ( صرف نظر از گاز های بی اثر که در لایه ی والانس 8 الکترون دارند) با گرفتن الکترون به آرایش گاز های بی اثر میرسند و پایدار می شوند و طی این فرایند دارای بار منفی میشوند. لازم به ذکر است که بار دار بودن یه همان عدم خنثایی اتم از مختلف شدن تعداد الکترون ها و پروتونها نشأت می گیرد که تساوی آنها در اتم موجب خنثی بودن اتم می شود چون الکترون ها و پروتون ها از نظر مقدار بار برابرند.


حین تغییر در میزان بار اتم، شعاع اتم هم تغییر می کند(شعاع اتم به فاصله ی هسته ی اتم از لایه ی ظرفیت یا همان آخرین لایه ی اتم گویند)
میدانیم که اتم فلزات هنگام تبدیل شدن به یون تمام الکترون های لایه ی والانس را از دست می دهد. پس در حقیقت از تعداد لایه های الکترونی آن کاسته می شود و شعاع اتمی کوچکتر می شود ( شعاع کاتیون همواره کوچکتر از شعاع اتمی مربوطه است).
میدانیم که اتم نافلزات هنگام تبدیل شدن به یون بر تعداد اتم های لایه ی والانسشان افزوده می شود (حین این که تعداد لایه های الکترونی ثابت می ماند) و البته میان الکترون ها و هسته جاذبه وجود دارد. با این عمل جاذبه ی هسته بر لایه ی والانس کاهش یافته شعاع افزایش می یابد.
وقتی اتم ها به یون تبدیل میشوند، خواص آنها شدیدا تغییر می کند. مثلاً مجموعهای از مولکولهای برم قرمز است. اما یونهای برم در رنگ بلور ماده مرکب هیچ دخالتی ندارند. یک قطعه سدیم شامل اتمهای سدیم نرم است. خواص فلزی دارد و بر آب به شدت اثر میکند. اما یونهای سدیم در آب پایدارند.
مجموعه بزرگی از مولکولهای کلر، گازی سمّی بهرنگ زرد مایل به سبز است، ولی یونهای کلرید مواد مرکب رنگ ایجاد نمیکنند و سمّی نیستند. به همین لحاظ است که یونهای سدیم و کلر را به صورت نمک طعام میتوان بدون ترس از واکنش شدید روی گوجه فرنگی ریخت.وقتی اتمها به صورت یون در میآیند، ماهیت آنها آشکارا تغییر میکند



خیلی خوب و کاربردی بود .ولی میشد توضیح گسترده تری نسبت به این موضوع داد